◯代表的な化学反応
| 分類 | 概要 | 代表的な化学反応式 |
| 中和 | 酸+アルカリ→塩+水 (酸性の原因である水素イオン(\( \displaystyle \mathrm{H^{+}} \))と、アルカリ性の原因である水酸化物イオン(\( \displaystyle \mathrm{OH^{-}} \))が反応し、互いの性質を打ち消す) | ◯\( \displaystyle \mathrm{HCl + NaOH \to NaCl + H_{2}O} \) ( 塩酸 )+( 水酸化ナトリウム )→(塩化ナトリウム)+(水) |
| 酸化(有機物の燃焼) | 有機物が完全燃焼し、二酸化炭素と水ができる反応。 | ◯\( \displaystyle \mathrm{CH_{4} + 2O_{2} \to CO_{2} + 2H_{2}O} \) ( メタン ) + (酸素) → (二酸化炭素) + (水) |
| 酸化(金属の燃焼) | 金属が燃焼(激しく酸化)し、酸化物ができる反応。 | ◯\( \displaystyle \mathrm{2Mg + O_{2} \to 2MgO} \) ( マグネシウム ) + (酸素) → ( 酸化マグネシウム ) ◯\( \displaystyle \mathrm{2Cu + O_{2} \to 2CuO} \) ( 銅 ) + (酸素) → ( 酸化銅 ) |
| 分解(熱分解) | 加熱により、1種類の物質が2種類以上の物質に分かれる反応。 | ◯\( \displaystyle \mathrm{2NaHCO_{3} \to Na_{2}CO_{3} + H_{2}O + CO_{2}} \) ( 炭酸水素ナトリウム )→( 炭酸ナトリウム )+(水)+(二酸化炭素) ◯\( \displaystyle \mathrm{2Ag_{2}O \to 4Ag + O_{2}} \) ( 酸化銀 )→( 銀 )+(酸素) |
| 分解(電気分解) | 電気エネルギーにより、1種類の物質が2種類以上の物質に分かれる反応。 | ◯\( \displaystyle \mathrm{2H_{2}O \to 2H_{2} + O_{2}} \) (水) →(水素) + (酸素) (陽極に 酸素 が発生、陰極に 水素 が発生) ◯\( \displaystyle \mathrm{CuCl_{2} \to Cu + Cl_{2}} \) ( 塩化銅 ) → ( 銅 ) + (塩素) (陽極に塩素 が発生、陰極に 銅 が付着) |
| 還元 | 酸化物が酸素を奪われる反応。酸化と同時に起こる。 | ◯\( \displaystyle \mathrm{2CuO + C \to 2Cu + CO_{2}} \) ( 酸化銅 ) + (炭素) → ( 銅 ) + (二酸化炭素) |
◯化学変化の量的関係
| 法則名 | 内容 | 具体例 |
| 定比例の法則 | 化合物をつくる元素の質量比は常に一定である。 | 質量比 銅:酸素= 4:1 で化合 |
| 質量比 マグネシウム:酸素= 3:2 で化合 | ||
| 質量保存の法則 | 化学変化の前後で、物質全体の質量は変わらない。 | 炭酸水素ナトリウムを加熱した後の全体の質量=加熱前の全体の質量 |
◯電池の原理(ボルタ電池)
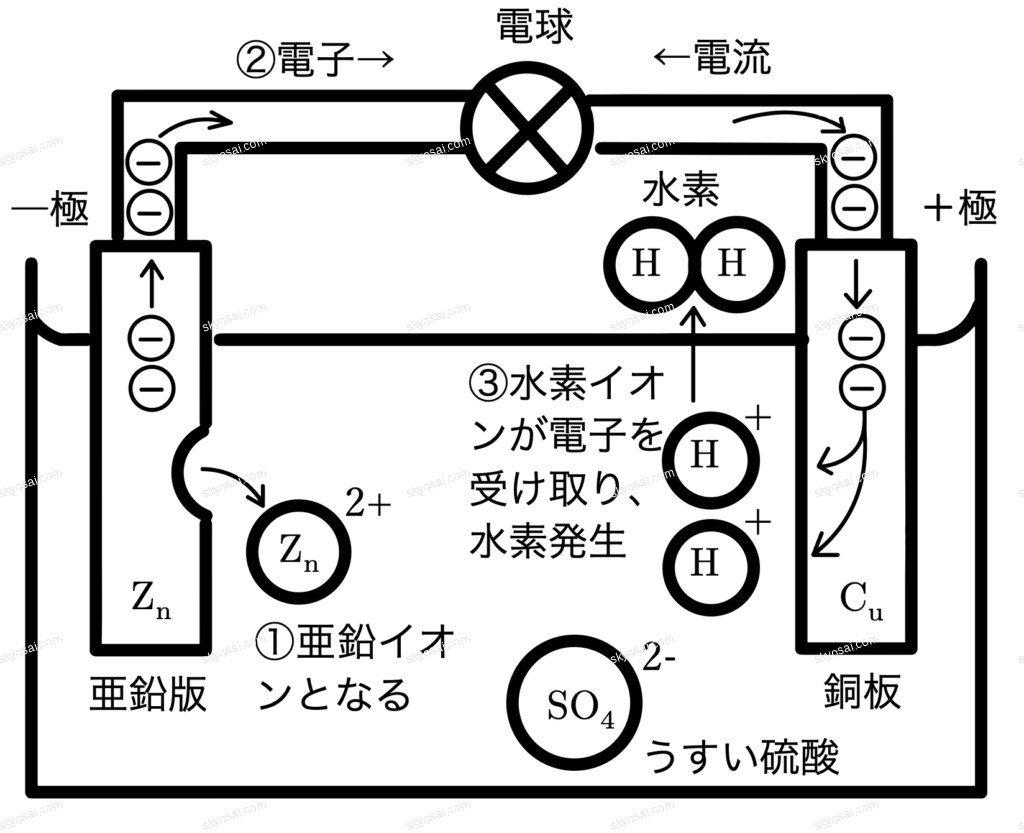
【前提】亜鉛(\( \displaystyle \mathrm{Zn} \))は銅(\( \displaystyle \mathrm{Cu} \))よりもイオン化傾向が 大きい 。
①このイオン化傾向の差により、よりイオンになりやすい 亜鉛(\( \displaystyle \mathrm{Zn} \)) が、電子(\( \displaystyle \mathrm{e^{-}} \))を放出して亜鉛イオン(\( \displaystyle \mathrm{Zn^{2+}} \))となり、水溶液に溶け出す(負極)。
②放出された電子(\( \displaystyle \mathrm{e^{-}} \))は、導線を通って銅板側(正極)へと移動する。
③銅板(正極)の表面で、水溶液中の水素イオン(\( \displaystyle \mathrm{H^{+}} \))が電子を受け取り、水素ガス(\( \displaystyle \mathrm{H_{2}} \))が発生する。
解説ー準備中
この記事は役に立ちましたか?
間違い/不具合かな?
と思ったらこちらへ